GLP-1RAs与颈动脉粥样硬化:临床试验详细解读
2025-09-23 09:53:48 by admin ![]() 255
255

导读:本次介绍的是一篇2025年5月刚发表于American Heart Journal 的临床试验,研究基于合并糖尿病和心血管疾病的人群(n=101),随机1:1分组接受司美格鲁肽(一种每周一次皮下注射的 GLP-1RA)和安慰剂治疗,评估GLP-RA对颈动脉管壁炎症和斑块特征的影响,其中PET-MRI用于评估斑块炎症,MRI用于评估斑块体积,脂质核体积和纤维帽厚度等。作者未发现GLP-1RA对管壁炎症的显著影响。值得一提的是,这是首次在人类中结合 PET 与 MRI来研究 GLP-1RA 对动脉粥样硬化的影响,本研究展示了在多中心环境下应用这些先进影像技术的可行性,同时采用标准化方案和集中化影像分析,对于未来相关研究的方法学发展具有重要意义。原文链接(https://pubmed.ncbi.nlm.nih.gov/40345413/),详细解读如下:
01/背景
胰高血糖素样肽-1 受体激动剂(GLP-1RAs)已成为治疗 2 型糖尿病(T2D)的公认降糖药物。在伴有较高心血管风险或已确诊心血管疾病的 T2D 患者中,部分 GLP-1RA 与安慰剂相比可降低主要不良心血管事件(MACE)的发生风险,因此被推荐作为此类患者的一线治疗选择。此外,GLP-1RA 对多种心脏代谢危险因素也有益处,包括降低体重、改善血脂谱,以及轻度降低血压。近期真实世界证据强调了司美格鲁肽(一种每周一次皮下注射的 GLP-1RA)在改善亚临床动脉粥样硬化方面的多效性。同样地,利拉鲁肽(另一种每日一次皮下注射的 GLP-1RA)已被证明可改善炎症标志物和血脂谱,这可能有助于其心血管保护作用。
炎症在动脉粥样硬化中的作用已被充分证实;然而,GLP-1RA 所介导的心血管获益机制仍不完全清楚。动物模型研究提示,GLP-1RA 治疗后的炎症减轻可能通过直接和间接作用于心脏与血管炎症,以及降低活化巨噬细胞活性,从而减缓动脉粥样硬化斑块的进展。与前临床研究一致,GLP-1RA 已被证实可降低 T2D 人群循环炎症标志物水平,如高敏 C 反应蛋白和单核细胞趋化蛋白-1。
本项心血管作用机制(MoA)试验在T2D合并已确诊心血管疾病患者中:
主要目标是评估每周一次(OW)皮下注射司美格鲁肽与安慰剂对颈动脉动脉粥样硬化炎症的影响,以基于PET-MRI 检测的 [18F]FDG 和 [68Ga]DOTATATE 作为评估指标。
次要目标是评估对动脉粥样硬化斑块形态及负荷的影响,以基于MRI的血管壁体积,斑块脂质核体积,和纤维帽厚度作为指标
02/方法
试验设计与受试者
本研究为一期、随机、双盲、平行组试验(NCT04032197)。入选标准为:年龄 ≥50 岁,T2D 诊断 ≥180 天,糖化血红蛋白(HbA1c)6.0%–9.0%,既往有动脉粥样硬化性心血管疾病病史。筛查前 90 天内接受 GLP-1RA 或系统性抗炎药物治疗的受试者被排除。
干预措施
受试者按 1:1 随机分配接受 OW 皮下注射司美格鲁肽或匹配安慰剂,治疗总持续时间为 52 周,并设 5 周的停药随访期。采用固定剂量递增方案:随机分组时给予 0.25 mg 司美格鲁肽或安慰剂,每 4 周剂量翻倍,直至达到维持剂量 1.0 mg;维持剂量持续至终点访视,允许根据需要调整剂量或延长剂量递增间隔。治疗依从性由研究者监测。
终点指标
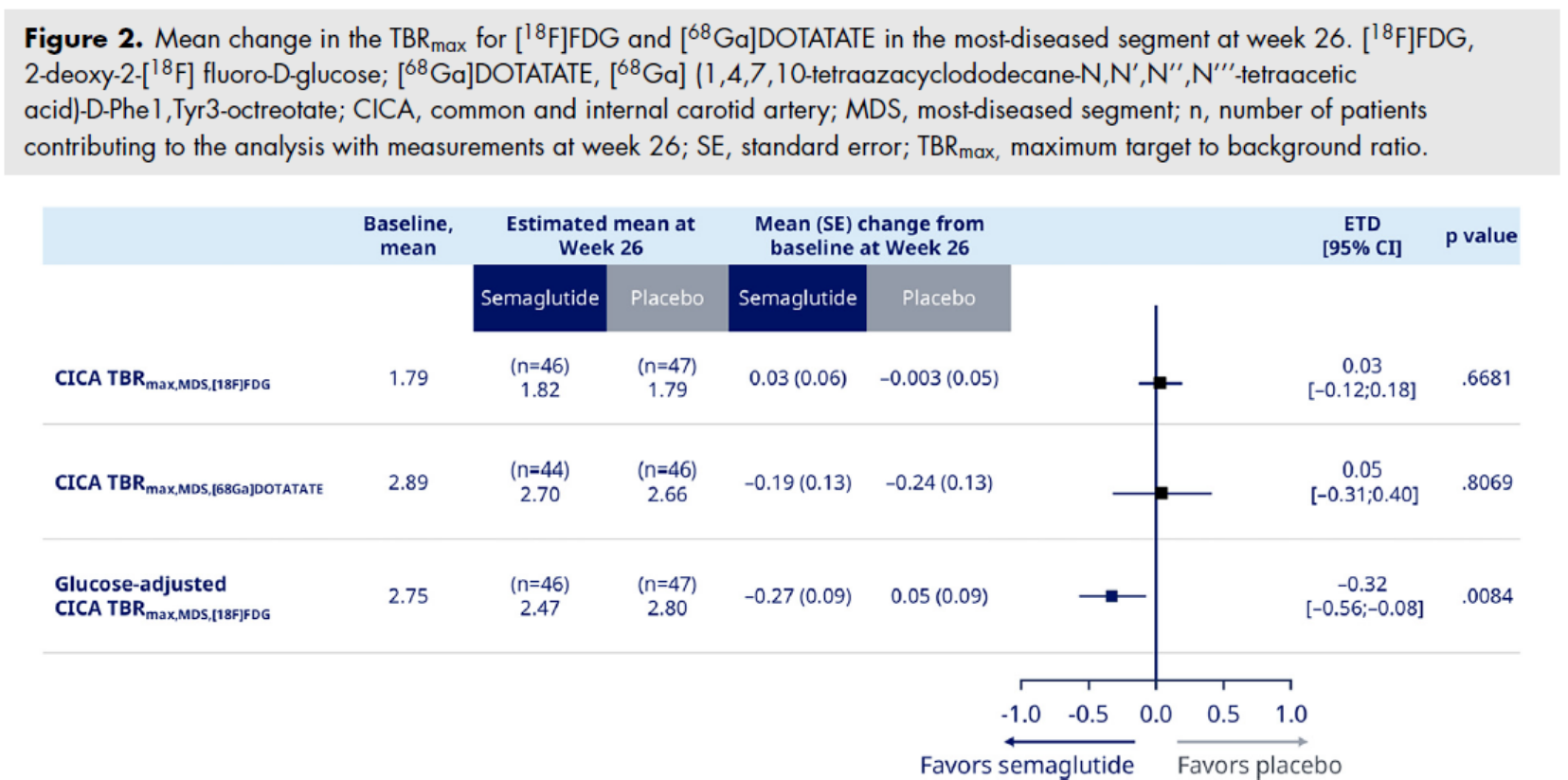
主要终点为基线至第 26 周颈动脉最严重节段 [18F]FDG 最大靶区/背景比值(TBRmax,MDS)的变化。
次要终点为基线至第 26 周颈动脉最严重节段 [68Ga]DOTATATE 最大 TBR 的变化(TBRmax,MDS)。
探索性终点包括基线至第 26 周葡萄糖校正后的 TBRmax变化
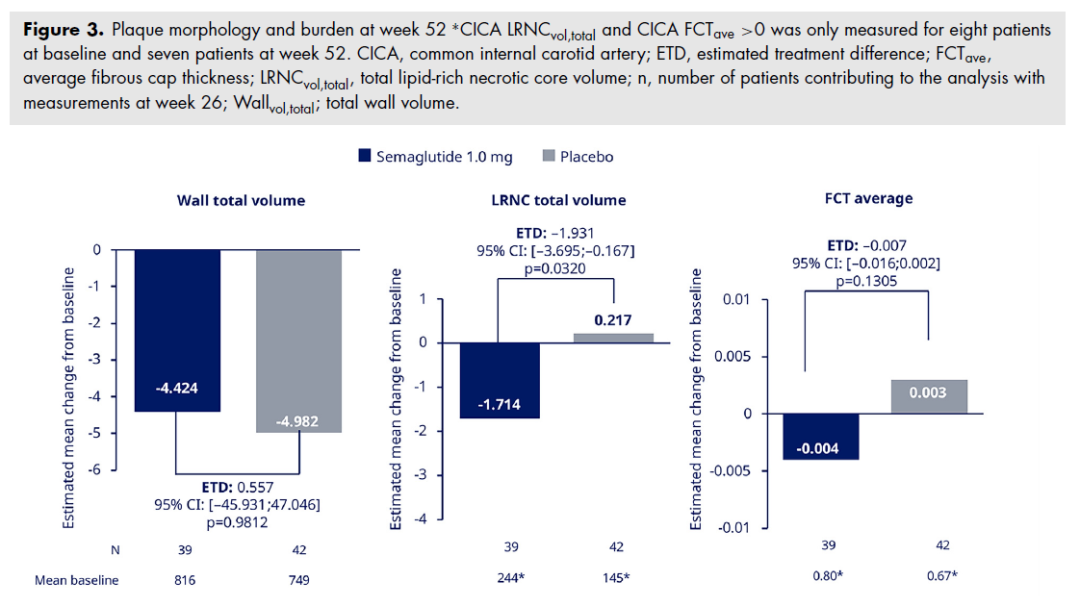
评估斑块形态与负荷的次要终点包括基线至第 52 周总血管壁体积、斑块脂质坏死核心体积及平均纤维帽厚度的变化,均通过 MRI 在最严重节段颈动脉评估。
MRI斑块形态分析
在颈动脉分叉处,受试者接受 TOF 和轴向 T1 加权扫描,随后静脉注射基于钆的造影剂并重复 T1 加权成像。增强与未增强影像由核心实验室(Antaros Medical,瑞典乌普萨拉)自主开发并验证的软件进行分析。斑块形态分析仅在基线斑块最大的一侧颈动脉进行,如未识别斑块,则选择血管壁最厚的一侧。分割时,手动描绘内外血管壁轮廓,血管壁体积定义为内外轮廓之间的体积。斑块内脂质坏死核心(LRNC)由分析师手动标注,通过增强与未增强图像切换识别。LRNC 在未增强图像上呈高信号或等信号,在增强图像上信号增强少或几乎无增强。纤维帽厚度通过算法评估。在含 LRNC 的切片中,分析师沿腔体周长标记纤维帽起止位置,并计算沿周长均匀分布的 100 条弦线至 LRNC 外边界的平均长度。斑块内出血区域定义为造影前图像中呈高信号的局灶结构。
03/结果
受试者分布及基线特征
在 2019 年 8 月 12 日至 2023 年 6 月 6 日期间,共有 101 名患者被随机分配至每周皮下注射 1.0 mg 司美格鲁肽组(n = 50)或安慰剂组(n = 51),研究在奥地利(n = 43)、丹麦(n = 30)和瑞典(n = 28)四个研究中心进行。在随机分配的患者中,司美格鲁肽组有 8 例、安慰剂组有 4 例患者因不同原因停止用药并退出试验。
患者的人口学及基线特征、心血管疾病史及合并用药总结如下表所示。基线时,患者平均年龄 66 岁;男性占比87.1%,平均 HbA1c 为 7.0%,体平局BMI为 29.1kg/m²;患者46.5%有心肌梗死史 ,23.8%有卒中史,大部分患者接受降糖、降压及降脂治疗。
动脉粥样硬化炎症
在主要和次要终点方面:司美格鲁肽组与安慰剂组在颈动脉最严重病变段的 [18F]FDG TBRmax 和[68Ga]DOTATATE TBRmax在第 26 周的变化无统计学显著差异(如下图)。
在探索性终点方面,调整血糖后的 [18F]FDG TBRmax 在第 26 周显示司美格鲁肽组下降 −0.268(0.087),而安慰剂组为 0.054(0.085),提示司美格鲁肽可能对血糖调整后的动脉炎症有一定抑制作用。
斑块形态
04/讨论
据我们所知,这是首次在人类中结合 PET 与 MRI(并使用两种不同示踪剂)来研究 GLP-1RA 对动脉粥样硬化炎症的影响,该方法有望提供独特的机制学见解。双示踪剂方法能够从不同角度提供斑块炎症的互补信息,其中 [68Ga]DOTATATE 的优势在于可评估与葡萄糖无关的治疗效应。本研究展示了在多中心环境下应用这些先进影像技术的可行性,同时采用标准化方案和集中化影像分析,对于未来相关研究的方法学发展具有重要意义。
本研究结果对探索 GLP-1RA 心血管效应具有启示意义。患者选择尤为关键,提示未来临床试验应考虑入组炎症标志物升高或活动性动脉粥样硬化病变明确的患者,以最大化检测治疗效应的潜力。我们的发现并不与司美格鲁肽在大型结局试验中观察到的公认心血管益处相矛盾,而是提示这些益处可能通过多条途径发挥,而不仅能通过颈动脉斑块影像学捕捉到。其他正在进行的研究也在进一步评估司美格鲁肽对动脉粥样硬化特征的作用机制。
综上,本研究利用 [18F]FDG 和 [68Ga]DOTATATE 的 PET-MRI 连续评估斑块炎症。司美格鲁肽对斑块炎症未显示显著影响,这可能与试验人群疾病程度低、基线斑块炎症较轻有关。然而,本研究结果并不排除司美格鲁肽在以往临床前及临床研究中观察到的抗炎作用。

 京公网安备 11010502042883号
京公网安备 11010502042883号