动脉粥样硬化细胞表型与转录图谱
2025-08-01 09:49:44 by admin ![]() 298
298
 导读:本次推文介绍的研究通过单细胞RNA测序和CITE-seq分析,深入探讨了人类颈动脉动脉粥样硬化中的细胞类型异质性及其与临床事件的关联。研究发现,斑块中的巨噬细胞、平滑肌细胞和成纤维细胞表现出显著的表型变化,揭示了平滑肌细胞向泡沫细胞转化的过程,以及巨噬细胞的增殖和转化。这些细胞类型的变化与动脉粥样硬化的进展和斑块不稳定性密切相关,尤其是在高危患者中。研究还发现,CD90可能在平滑肌细胞的表型转变中发挥重要作用,提示其可能成为动脉粥样硬化治疗的新靶点。这些发现为动脉粥样硬化的精准治疗提供了新的理论基础和研究方向(原文链接(https://www.ahajournals.org/doi/10.1161/ATVBAHA.123.320524)。简要翻译如下:
导读:本次推文介绍的研究通过单细胞RNA测序和CITE-seq分析,深入探讨了人类颈动脉动脉粥样硬化中的细胞类型异质性及其与临床事件的关联。研究发现,斑块中的巨噬细胞、平滑肌细胞和成纤维细胞表现出显著的表型变化,揭示了平滑肌细胞向泡沫细胞转化的过程,以及巨噬细胞的增殖和转化。这些细胞类型的变化与动脉粥样硬化的进展和斑块不稳定性密切相关,尤其是在高危患者中。研究还发现,CD90可能在平滑肌细胞的表型转变中发挥重要作用,提示其可能成为动脉粥样硬化治疗的新靶点。这些发现为动脉粥样硬化的精准治疗提供了新的理论基础和研究方向(原文链接(https://www.ahajournals.org/doi/10.1161/ATVBAHA.123.320524)。简要翻译如下:

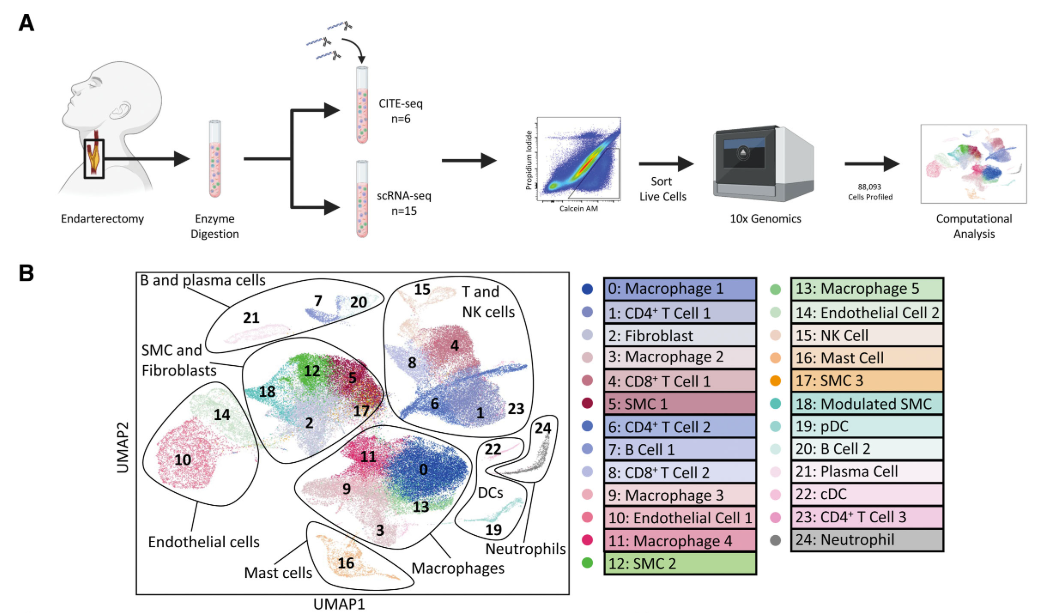
在巨噬细胞中,发现了:
2种促炎亚群,分别富含白细胞介素1B(IL-1B)或补体成分C1Q的表达; 2种TREM2+泡沫细胞(TREM2+ 通常被认为具有调节脂代谢和限制过度炎症的潜力;其中一种表达炎症相关基因); 具有增殖性基因特征的亚群; 和富含SMCs特异性基因的亚群,该亚群表现出纤维化通路上调。
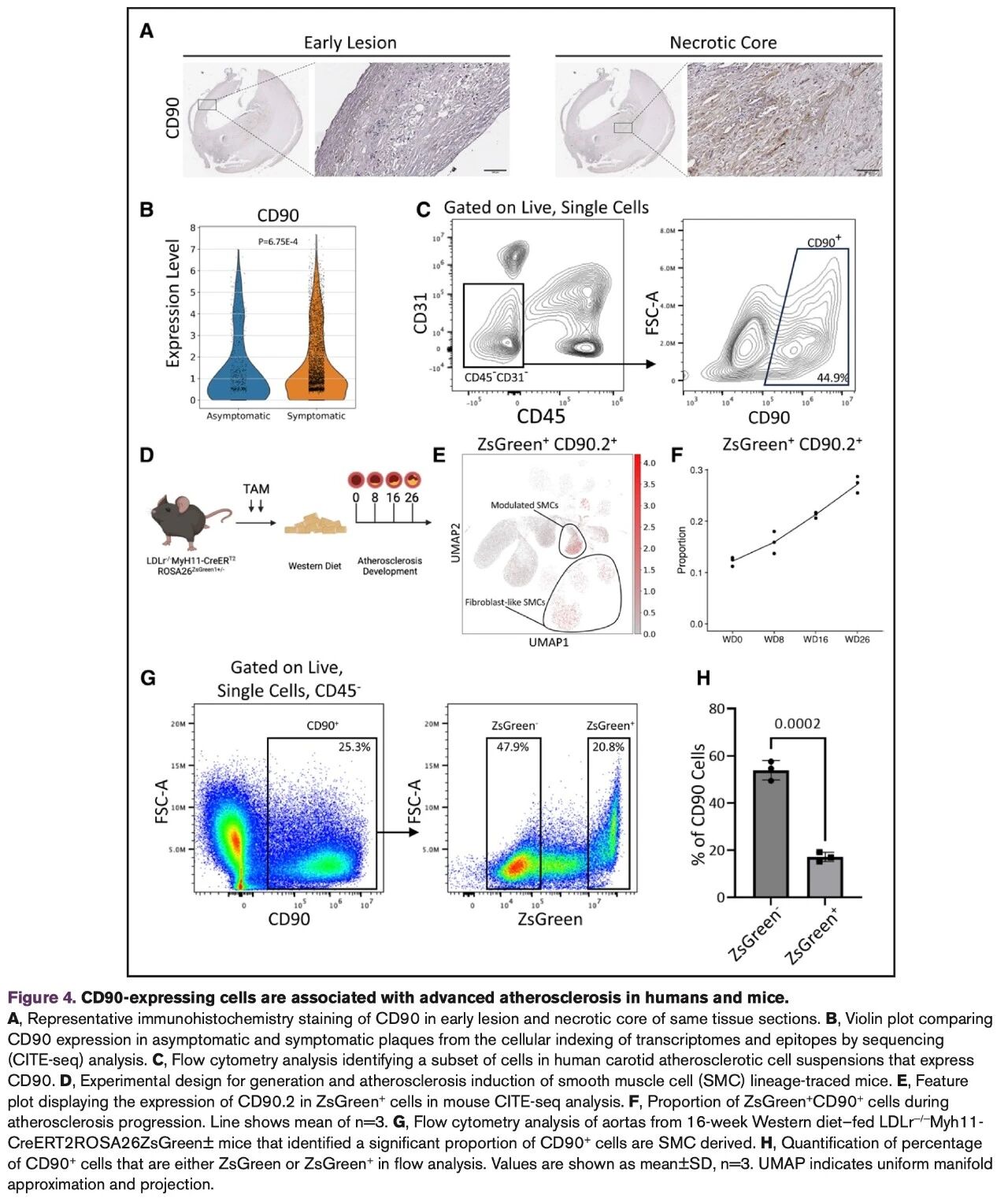
我们通过免疫组织化学染色观察到,CD90在晚期粥样硬化病变的坏死核心区域显著表达(图4A)。
此外,CITE-seq数据显示,有症状患者斑块中的CD90表达水平显著高于无症状患者(图4B)。
流式细胞术进一步验证了从颈动脉粥样硬化斑块的细胞悬液中可分选出一类 CD45⁻CD31⁻CD90⁺的特异性细胞群体(图4C)。
我们进一步在小鼠模型中验证CD90⁺SMC来源细胞的存在:
小鼠分别接受0、8、16与26周的高脂饮食处理(图4D),并在各时间点收集主动脉,使用119抗体的CITE-seq panel进行分析。我们观察到CD90.2主要富集于表型转化SMCs和类成纤维细胞样SMCs中(图4E),这与人类CITE-seq分析结果一致。
更重要的是,随着动脉粥样硬化进展,SMC来源的CD90.2⁺细胞逐渐增加(图4F)。
此外,我们在接受16周高脂饮食的小鼠中进行流式细胞术进一步验证,首先筛除CD45⁺白细胞(排除免疫细胞影响),再在CD45⁻群体中筛选CD90⁺细胞,发现其中约20%的CD90⁺细胞来源于SMC(图4G–H)。
结论:本研究构建的粥样硬化中细胞群体的多组学图谱揭示了人类颈动脉粥样硬化中细胞的多样性、表型、分化方式及其临床相关性。这些发现有助于将心血管疾病的易感基因位点映射到特定细胞类型上,并为该疾病的治疗提供新的分子及细胞靶点。


 京公网安备 11010502042883号
京公网安备 11010502042883号